
Farbursachen
Die Farbe eines Schmuckdiamanten ist einer der vier Parameter, die den Wert eines geschliffenen und polierten Steines bestimmen. Bis in die Gegenwart erzielte ein vollständig farbloser Diamant den höchsten Preis. Die Mehrheit der Schmuckdiamanten hat mit blassen gelben oder braunen Farbtönungen wenig attraktive Farben und deutlich herabgesetzte Wertschätzung. Farbige Diamanten in Rot, Blau oder Grün waren als relative Seltenheiten schon lange bekannt. Sie waren aber als Schmucksteine kaum gefragt, es sei denn dass sie durch besondere Größe und intensive Farbe auffielen. Es gab aber schon über längere Zeiten Liebhaber, die besonders reizvolle Kollektionen farbiger Diamanten zusammenstellten. In den letzten Jahren hat sich nun jedoch ein größeres Interesse an den sogenannten "fancy coloured diamonds" (phantasiefarbene Diamanten) entwickelt und verbreitert. Mit dem Zusatz "fancy" bezeichnet man alle farbigen Diamanten in Edelsteinqualität mit Ausnahme der natürlich gelbgetönten ("Cape") und naturbraunen Steine.

Wenn ein Diamant farbig ist muß er vom sichtbaren weißen Licht im Wellenlängenbereich zwischen etwa 400 nm (violett) und 700 nm (rot) bestimmte Anteile absorbieren, wobeoi der nicht absorbierte Rest die Farbe ergibt.
Wie schon erwähnt, ist ein reiner perfekter Diamantkristall im gesamten sichtbaren Spektralbereich hoch transparent, also farblos. Die Ursachen für die Farben der Diamanten müssen dann Störungen in der Regelmäßigkeit der Kohlenstoffatome in der Kristallstruktur sein. Solche Störungen können chemischer Natur sein, indem ein Teil der Kohlenstoffatome durch andere Atomarten ersetzt wird, oder kristallstruktureller Natur sein, indem einzelne Kohlenstoffatome oder ganze Atomlagen um Vektorbeträge in Größe der Elementarzelle versetzt sind. Es sind also chemische und kristallstrukturelle Defekt, häufig miteinander gekoppelt auftretend. Die vielen so ableitbaren Defektarten (etwa vierzig beim Diamant) können im gesamten Bereich der Transparenz der Diamanten Absorptionen (breitere Banden oder schmalere Linien) verursachen, doch nur wenn sie im sichtbaren Spektrum absorbieren nennen wir sie Farbzentren.
Ganz entscheidend für Störungen chemischer Natur ist der Gehalt an Stickstoff, der maximal bis zu 0,5% im Diamant enthalten sein kann. Nach der Höhe des Stickstoffgehaltes, die auch Einfluß auf weitere physikalische Eigenschaften hat, teilt man die Diamanten in zwei Typen:
- Typ I mit hohem Stickstoffgehalt etwa zwischen 100-3000 ppm (parts per million)
- Typ II mit niedrigem Stickstoffgehalt etwa zwischen 4 – 40 ppm.
Dazu einige Zahlenbeispiele:
Ein Kubikmillimeter (1 mm3) Diamant, das entspricht einem Brilliant von etwa 1/12 ct mit einem Rundistendurchmesser von 3 mm, enthält 2.1020 Kohlenstoffatome. Ersetzen wir einhundert von einer Million Kohlenstoffatomen durch Stickstoffatome (≡100 ppm N), so sind in dem einen mm3 2.1016 N Atome enthalten. Bei einem Gehalt von 100 ppb (parts per billion) N, der schon weit unter der Nachweisgrenze der meisten Analysegeräte liegt und wo der entsprechende Diamant dann als stickstofffreier Typ II gilt, sind es immer noch 2.1013 N-Atome/mm3. Theoretisch ergibt das eine Konzentration von 1013/mm3 an Farbzentren mit der Bezeichnung H3, drei benachbarte Kohlenstoffatome sind durch zwei Stickstoffatome und eine Leerstelle ersetzt, und einer Absorptionslinie bei einer Wellenlänge von 503 nm.
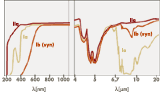 Eine weitere Untergliederung der Diamanten erfolgt im wesentlichen auf der Basis ihrer Infrarot-Absorption in Ia- (sie machen den weitaus größten Anteil aller Diamanten mit über 95% aus), Ib-, IIa- und IIb-Diamanten. Letztere sind in der Natur extrem selten. Sie haben einen sehr niedrigen Stickstoffgehalt, so dass geringe Borgehalte nicht kompensiert werden und die Boratome als Akzeptoren fungieren, womit der Diamant ein p-Typ Halbleiter ist. Daraus folgt eine optische Absorption, die im Infraroten bei etwa 4 µm beginnt und sich in den roten Bereich des Spektrums fortsetzt, was eine attraktive blaue Farbe ergeben kann. Eine weitere Untergliederung der Diamanten erfolgt im wesentlichen auf der Basis ihrer Infrarot-Absorption in Ia- (sie machen den weitaus größten Anteil aller Diamanten mit über 95% aus), Ib-, IIa- und IIb-Diamanten. Letztere sind in der Natur extrem selten. Sie haben einen sehr niedrigen Stickstoffgehalt, so dass geringe Borgehalte nicht kompensiert werden und die Boratome als Akzeptoren fungieren, womit der Diamant ein p-Typ Halbleiter ist. Daraus folgt eine optische Absorption, die im Infraroten bei etwa 4 µm beginnt und sich in den roten Bereich des Spektrums fortsetzt, was eine attraktive blaue Farbe ergeben kann.
Bei den Ib-Diamanten, sehr selten in der Natur, doch fast alle synthetischen Diamanten sind von diesem Typ, liegen die Stickstoffatome isoliert als Substitute von Kohlenstoffatomen in der Kristallstruktur vor. Stickstoff in dieser Form wird häufig mit C bezeichnet. Er verursacht eine Absorption beginnend bei etwa 500 nm und ansteigend zu kürzeren Wellenlängen. Das ergibt eine blassgelbe bis gelbbraune Farbe je nach Konzentration und Größe. In dieser Form im Kristall erzeugt Stickstoff eine paramagnetische Resonanz.
Bei den Ia-Diamanten liegen die Stickstoffatome in aggregierter Form in der Kristallstruktur vor, d.h. zwei oder mehr N-Atome als direkte Nachbarn besetzen Positionen von Kohlenstoffatomen. Als A-Form bezeichnet man Paare von Stickstoffatomen. Liegt der Strickstoffanteil überwiegend in dieser Form vor, bezeichnet man diese Diamanten als IaA-Typ. Analoges gilt für den IaB-Typ, bei dem Aggregate von 4 (eventuell auch 6 oder 8) benachbarten Stickstoffatomen vorliegen. Oft liegt der Stickstoffgehalt in etwa gleichen Anteilen an A- und B-Form vor, dann als IaAB bezeichnet. A- und B-Aggregate erzeugen im sichtbaren Bereich keine Absorption, was auch logisch erscheint, da es ja sonst nicht soviel farblose Schmuckdiamanten vom Ia-Typ geben würde. Sie ergeben aber im Ultravioletten ab etwa 320 nm bis zur Absorptionskante aller Diamanten bei 250 nm eine ansteigende Absorptionsintensität.
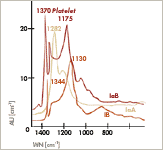 Wichtig für die Diagnostik und die analytische Ableitung der Stickstoffgehalte sind ihre Absorptionsspektren im infraroten Bereich der Wellenlängen zwischen 7 und 10 µm in der sogenannten Ein-Phononen-Region. Sie sind als Absorptionsbänder charakteristisch geformt mit Peaks bei Wellenzahlen von 1282 cm-1 (A) und 1165 cm-1 (B). Eine oft mit höheren B-Gehalten gekoppelte Absorptionslinie bei Wellenzahlen um 1165 cm-1 wird durch die sogenannten Platelets verursacht. Während alle bisher auf Stickstoff und Bor zurückgeführten Defekte quasi als Punktdefekte gelten, handelt es sich hierbei um ausgedehnte Defekte, Aggregate in lamellarer Form von Leerstellen und Stickstoffatomen, die Größen von einigen Mikrometern erreichen können und dann auch elektronen- und sogar lichtmikroskopisch beobachtet werden. Wichtig für die Diagnostik und die analytische Ableitung der Stickstoffgehalte sind ihre Absorptionsspektren im infraroten Bereich der Wellenlängen zwischen 7 und 10 µm in der sogenannten Ein-Phononen-Region. Sie sind als Absorptionsbänder charakteristisch geformt mit Peaks bei Wellenzahlen von 1282 cm-1 (A) und 1165 cm-1 (B). Eine oft mit höheren B-Gehalten gekoppelte Absorptionslinie bei Wellenzahlen um 1165 cm-1 wird durch die sogenannten Platelets verursacht. Während alle bisher auf Stickstoff und Bor zurückgeführten Defekte quasi als Punktdefekte gelten, handelt es sich hierbei um ausgedehnte Defekte, Aggregate in lamellarer Form von Leerstellen und Stickstoffatomen, die Größen von einigen Mikrometern erreichen können und dann auch elektronen- und sogar lichtmikroskopisch beobachtet werden.
Bei den relativ seltenen IIa-Diamanten , wo an Stickstoff gebundenen Farbzentren weniger zu erwarten sind, spielen strukturell Defekte eine größere Rolle. Auch hier reichzt die Palette von Punktdefekten (Leerstellen, Interstitials = Atome auf Zwischengitterplätzen) über Liniendefekte (Versetzungslinien von verschiedenen Versetzungstypen) zu den Flächendefekten (Gleitungen, Stapelfehler, Mikrorupturen).
Die Braunfärbung der IIa-Diamanten mit einer untypischen kontinuierlichen Absorption im Sichtbaren, ist überwiegend auf solche strukturellen Defekte zurückzuführen, die durch zum Teil intensive plastische Deformationen entstanden sind. Einige diskrete Absorptionslinien an beiden Enden des sichtbaren Spektrums lassen sich auf Leerstellen zurückführen.
|


